Come calcolare l'ordine dei titoli e la lunghezza del legame
 Share
Share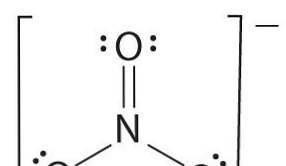
Determinare determinati parametri come dimensioni, lunghezza e angolo in scala atomica non è facile. A causa dell'importante di questi parametri, gli scienziati hanno sviluppato metodi per dedurre o calcolare i parametri a livello atomico. L'ordine di legame e la durata del legame sono due parametri così importanti che indicano il tipo e la forza dei legami tra una coppia di atomi.
Questo articolo spiega,
1. Che cosa sono l'ordine dei legami e la lunghezza del legame
2. Come calcolare l'ordine dei titoli e la lunghezza del legame
- Come calcolare l'ordine delle obbligazioni
- Come calcolare la lunghezza del legame
Cosa sono l'ordine dei legami e la lunghezza del legame
La lunghezza del legame e l'ordine di legame sono due parametri associati ai legami covalenti. L'ordine di legame è il numero di legami chimici tra due atomi e la lunghezza del legame è la distanza tra due nuclei di atomi che sono legati covalentemente insieme.Questo articolo spiega come calcolare l'ordine dei bond e la lunghezza dei bond a livello atomico.
Come calcolare l'ordine delle obbligazioni
L'ordine delle obbligazioni è il numero di legami chimici tra due atomi. Indica la stabilità di un legame. Nei legami covalenti, l'ordine del legame è il numero di elettroni condivisi. Ad esempio, l'ordine di legame di una coppia di atomi legati da un singolo legame è uno, mentre l'ordine di legame di una coppia di atomi legati da un doppio legame è due. L'ordine di legame zero indica che non vi è alcun legame tra gli atomi. La stabilità di una molecola aumenta con l'aumentare dell'ordine dei legami. Le molecole con legame di risonanza non hanno bisogno di essere un numero intero. Nei composti covalenti con due atomi, l'ordine di legame tra una coppia di atomi viene determinato prima disegnando la struttura di Lewis e quindi determinando il tipo di legami tra gli atomi - legame zero, singolo, doppio o triplo legame. Ad esempio, l'ordine di legame dell'idrogeno è determinato come segue.
- Disegna la struttura di Lewis
H: H
- Determina il numero di legami / coppia di elettroni di valenza
Una coppia di elettroni, quindi l'ordine di legame è 1.
Se ci sono più di due atomi, l'ordine del legame è determinato come segue. Vedere l'esempio: ione nitrato.
- Disegna la struttura di Lewis

- Contare il numero totale di legami (secondo lo ione nitrato, il suo 4)
- Il numero di gruppi di obbligazioni tra singoli atomi (secondo l'ammoniaca, i suoi 3)
- Pertanto, l'ordine obbligazionario = numero totale di obbligazioni / numero di gruppi obbligazionari
= 4/3
= 1,33
Pertanto, l'ordine di legame dello ione nitrato è 1,33
Come calcolare la lunghezza del legame
La lunghezza del legame è la distanza tra due nuclei di atomi legati in modo covalente. La lunghezza del legame è di solito nell'intervallo da 0,1 a 0,2 nm. Quando due atomi simili sono legati insieme, la metà della lunghezza del legame viene indicata come raggio covalente. La lunghezza del legame dipende dal numero di elettroni legati di due atomi o dall'ordine di legame. Più alto è l'ordine di legame, più breve la lunghezza del legame sarà dovuta alle forti forze di trazione dei nuclei caricati positivamente. L'unità di lunghezza del legame è picometer. In obbligazioni singole, doppie e triple, la lunghezza del legame aumenta nell'ordine di
triplo legame L'elettronegatività può essere utilizzata per calcolare la lunghezza del legame tra due atomi aventi differenti elettronegatività. La seguente formula empirica è stata proposta da Shoemaker e Stevenson per calcolare la lunghezza del legame. dA-B = rUN + rB - 0,09 (xUN - XB) dA-B è la distanza di legame tra due atomi A e B, rUN e rB sono raggi covalenti di A e B, e (XUN - XB) è la differenza di elettronegatività tra A e B. Un altro metodo è usato per calcolare la lunghezza approssimativa del legame. In questo metodo, viene disegnata la prima struttura di Lewis per determinare il tipo di legame covalente. Quindi usando un grafico * fatto sugli studi fatti da Cordero et al., e Pyykkö e Atsumi, i raggi corrispondenti dei legami fatti da ciascun atomo sono determinati. Quindi la lunghezza del legame viene determinata prendendo la somma dei due raggi. Ad esempio, quando si determina la lunghezza del legame dell'anidride carbonica, viene disegnata la prima struttura di Lewis. Secondo il grafico, il raggio covalente del doppio legame di carbonio è di 67 picometri e quello del doppio legame di ossigeno è di 57 picometri. Pertanto, la lunghezza del legame di anidride carbonica è di circa 124 picometri (57 pm + 67 pm). * La tabella covalente si trova qui Riferimento: Cordero, Beatriz, et al. "Raggio covalente rivisitato." Dalton Transactions 21 (2008): 2832-2838. Libretexts. "Ordine dei titoli e lunghezze". LibreTexts di chimica. Libretexts, 05 dic. 2016. Web. 10 gennaio 2017. Lister, Ted e Janet Renshaw. Comprensione della chimica per il livello avanzato. N.p .: Nelson Thornes, 2000. Stampa. Pratiyogita Darpan. "Proprietà degli elementi in relazione alla loro struttura elettronica". Concorso Science Vision agosto 1998: n. pag. Stampare. Pyykkö, Pekka e Michiko Atsumi. "Radi covalenti molecolari a doppio legame per elementi Li-E112." Chemistry-A European Journal 15.46 (2009): 12770-12779.
