Differenza tra alcalinità e basicità
 Share
Share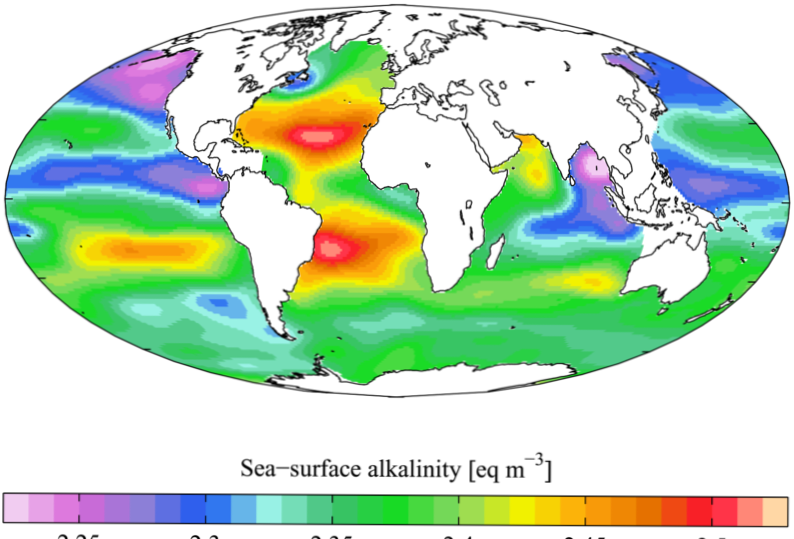
Differenza chiave - alcalinità vs. basicità
I due termini "alcalinità" e "basicità" sono piuttosto confusi. La maggior parte delle persone sa che c'è una differenza tra questi due parametri, ma solo alcuni sono in grado di definirlo correttamente. Il differenza fondamentale tra questi due termini è meglio spiegato nelle loro definizioni. La basicità è una misura che dipende direttamente dalla scala del pH e l'alcalinità è la quantità di acido necessaria per abbassare il pH in un valore acido significativo; è anche conosciuto come il capacità tampone di un corpo idrico. In altre parole, il valore del pH delle soluzioni di base varia da 7 a 14; dove le soluzioni con valori di pH elevati sono più basilari. Entrambi hanno diverse definizioni, ma l'idea generale è simile.
Cos'è l'alcalinità?
L'alcalinità è uno dei parametri più importanti nei corpi acquatici ed è molto essenziale per gli organismi acquatici. L'alcalinità misura la capacità dei corpi idrici di neutralizzare acidi e basi. In altre parole, è la capacità tampone di un corpo idrico di mantenere il valore pH ad un valore abbastanza stabile. Acqua contenente bicarbonati (HCO3-), carbonati (CO32-) e idrossidi (OH-) è un buon buffer; possono combinarsi con H+ ioni in acqua per aumentare il pH (diventa più basilare) dell'acqua. Quando l'alcalinità è troppo bassa (la capacità tampone è bassa), qualsiasi acido aggiunto al corpo idrico abbassa il pH a un valore acido più alto.
 Cos'è la basicità?
Cos'è la basicità?
La basicità è una proprietà di basi, misurata in scala di pH. Le basi sono i composti contenenti pH superiore a 7; da pH = 8 (meno di base) a pH = 18 (più di base). La base di un composto può essere definita in tre modi diversi. Secondo la teoria di Arrhenius, le basi sono le sostanze che si dissociano in mezzo acquoso producendo OH- ioni. Nella teoria di Bronsted-Lowry, gli accettori di protoni sono chiamati basi. Secondo la teoria di Lewis, un donatore di coppie di elettroni è chiamato una base. La basicità è la forza di ionizzazione per produrre OH- ioni, capacità di accettare protoni o capacità di donare elettroni.

Thomas Martine Lowry - Bronsted-Lowry Theory
Qual è la differenza tra alcalinità e basicità?
Definizione di alcalinità e basicità:
Alcalinità: Diverse definizioni ci sono.
L'alcalinità è la capacità neutralizzante dell'acido dei soluti in un campione d'acqua misurato in milliequivalenti per litro.
La somma delle specie chimiche di titolato carbonato e non carbonato in un campione di acqua filtrata.
La capacità dell'acqua di neutralizzare una soluzione acida.
La capacità tampone dell'acqua per mantenere un pH abbastanza stabile, senza alterare il suo valore di pH, quando si aggiunge acido.
basicità: Tre teorie sono utilizzate per definire l'acidità e la basicità.
Arrenhius: Le basi sono le specie che ionizzano per produrre OH- in acqua. La basicità aumenta mentre ionizzano di più, dando OH- in acqua.
Brønsted-Lowry: Proton (H+) gli accettori sono chiamati basi.
Lewis: I donatori di coppie di elettroni sono chiamati basi.
Fattori che influenzano l'alcalinità e la basicità:
Alcalinità: L'alcalinità non dipende dal valore del pH; i corpi idrici possono avere un valore pH inferiore (molto acido) o superiore (base) con un valore più elevato per l'alcalinità. L'alcalinità è determinata da diversi fattori come rocce, suolo, sali e certe attività industriali (le acque di scarico contenenti sapone e detergenti sono alcaline) dall'uomo. Ad esempio, le aree dove calcare (CaCO3) è significativamente disponibile può avere più acqua alcalina.
basicità: I fattori che influenzano la basicità di un composto variano a seconda della definizione della basicità. Ad esempio, la disponibilità di una base di coppie di elettroni dipende da tre fattori.
elettronegatività: CH3-> NH2-> HO-> F-
Quando si considerano gli atomi nella stessa riga nella tavola periodica, l'atomo più elettronegativo ha la più alta basicità.
Taglia: F-> Cl-> Br-> I-
Quando si considera una riga della tavola periodica, più grande è l'atomo meno denso di elettroni e meno essenziale.
Risonanza: RO-> RCO2-
Le molecole che hanno più strutture di risonanza sono meno essenziali, poiché la disponibilità di elettroni è minore di una carica negativa localizzata.
Cortesia dell'immagine:
1. “WOA05 GLODAP pd ALK AYool"Di Plumbago - Opera propria. [CC BY-SA 3.0] via Commons
2. “Thomas Martin Lowry2"Di Anonimo - Necrologio dal Faraday Soc. (1936). [Dominio pubblico] via Commons
